Entalpia
Por Redação
5. Entalpia (H)
Entalpia é o conteúdo energético global de um sistema, ou seja, a soma da energia química e da energia térmica.
É indicada por: H
Quando há uma reação no estado do sistema, a variação de entalpia (∆H) é determinada por:
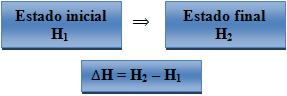
Onde:
H1 – entalpia do sistema no seu estado inicial.
H2 = entalpia do sistema no seu estado final.
Quando a pressão e a temperatura forem as mesmas desde o estado inicial até o final, o calor da reação será a mediada do ∆H.
Na reação exotérmica, temos H2 menor que H1, de modo que ∆H tem valor negativo.
Exemplo:
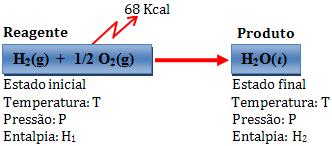
Variação de entalpia:
∆H = H2 – H1 = -68 kcal
Deste modo, um mol de água líquida possui uma energia 68 kcal a não ser que o sistema formado por 1 mol de H2 e 1/2 mol de O2 gasosos.
Através dos valores imaginários de entalpia, torna-se mais fácil para o leitor compreender o sinal de ∆H.
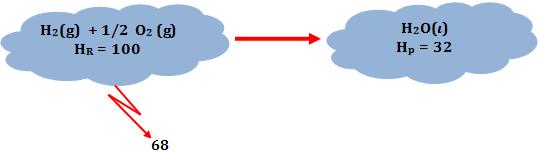
∆H = Hp – HR = 32 – 100 = – 68
Onde:
HR = entalpia dos reagentes
Hp = entalpia dos produtos
A equação pode ser escrita assim:
H2(g) + 1/2 O2(g) → H2O(l) ∆H = – 68 kcal
Normalmente, o calor de reação seria um “produto”:
H2(g) + 1/2 O2(g) → H2O(l) + 68 kcal

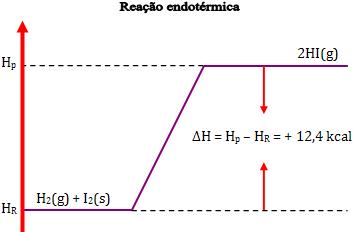
Na reação endotérmica, temos H2 maior que H1, de maneira que ∆H tem um valor positivo.
Exemplo:
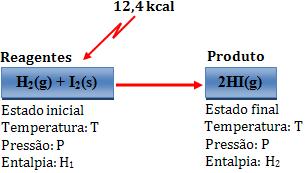
Variação de entalpia:
∆H = H2 – H1 = 12,4 kcal
Desse modo, dois mols de Hl gasoso possuem energia 12,4 kcal a mais que o sistema formado por 1 mol de H2 gasoso e 1 mol de I2 sólido.
Através dos valores imaginários, temos:
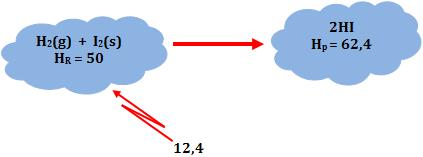
∆H = Hp – HR = 62,4 – 50 = 12,4
A equação pode ser escrita assim:
H2(g) + I2(s) → 2 HI(g) ∆H = + 12,4 kcal
Normalmente, o calor da reação seria um “reagente”.
H2(g) + I2(s) + 12,4 kcal → 2 HI(g)
ou
H2(g) + I2(s) → 2 HI(g) – 12,4 kcal
