Fórmula Eletrônica ou de Lewis:
Por Redação
Assim sendo, os átomos podem formar ligações por métodos diversos.
Tipos de Ligação
Ligação Iônica ou Eletrovalente – é o tipo de ligação que ocorre entre metal e ametal (ou hidrogênio). Na ligação iônica, teremos transferência definitiva de elétrons, originando cátions e ânions, que sofrem atração eletrostática formando uma substância sólida em condições ambientes (25°C e 1atm). Não existem moléculas nos sólidos iônicos. O que eles apresentam é um conjunto de íons bem organizados, em proporção definida, denominado retículo cristalino.
Cloreto de Sódio
Sejam as configurações eletrônicas do 11Na e 17Cl
Na: 2 – 8 – 1 Cl: 2 – 8 – 7
Para estabilizar o Na é melhor ganhar 7 elétron ou perder 1 elétron ? Será mais conveniente perder 1 elétron.
Para o Cl será melhor ganhar 1 elétron.
Sendo assim o sódio ficará com a configuração do 10Ne e o Cl com a do 18Ar .
Quando o n.° de elétron é menor que o de prótons o composto é um cátion, mas quando o n.° de elétron é maior do que o de prótons o composto é um ânion.
Na ligação iônica, teremos sempre transferência de elétrons. 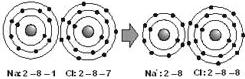
Utilizando o método de Lewis, no qual é representado o último nível eletrônico do átomo ou camada de valência por pontos.

Fórmula eletrônica ou de Lewis:
Propriedades dos compostos iônicos – Um composto é iônico quando apresenta em sua estrutura pelo menos uma ligação iônica, pode ter ligações covalentes.
– São sólidos cristalinos.
– Geralmente são solúveis em água, e a solução resultante conduz corrente elétrica.
– Possuem altas temperaturas de fusão e de ebulição (portanto, resistem ao calor). Por exemplo, o cloreto de sódio tem TF = 800°C e TE = 1400°C.
Ligação Covalente – A ligação covalente ocorre quando há compartilhamento ordenado de pares de elétrons entre os átomos envolvidos. Tal compartilhamento, geralmente, ocorre entre os ametais ou entre esses e o hidrogênio. Observando os exemplos abaixo, podemos notar como o processo ocorre.
a) 9F: 1s2 2s2 2p5 (7 elétrons na camada de valência).

 Substâncias Covalentes e Moleculares
Substâncias Covalentes e Moleculares