O que é Equilíbrio Iônico
Por Redação
Equilíbrio Iônico
Trata-se de um sistema em equilíbrio em que há pelo menos um íon no equilíbrio.
Constante de equilíbrio iônico (Ki)
Dedução do Ki:
HNO3(l) +H2O(l) ![]() H+(aq) + NO-3(aq)
H+(aq) + NO-3(aq) 
constante, pois é o meio onde a reação ocorre.
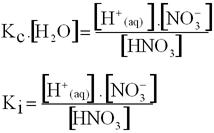
Sinônimos do Ki
a) Constante de equilíbrio para ácidos (Ka) ou constante de ionização para ácidos (Ka).
b) Constante de equilíbrio iônico para base (Kb) ou constante de dissociação para base (Kb).
c) Constante de equilíbrio iônico para água ou produto iônico da água (Kw).
d) Constante de hidrólise (Kh).
Observação – Não se define equilíbrio iônico para compostos tipicamente iônicos, ou seja, bases fortes e sais solúveis provenientes de reações de ácido forte com base forte, pois sua dissociação é considerada 100% e, portanto, o sistema é simples e não reversível, sendo assim, jamais entrará em equilíbrio.
Aplicações
01. Dado o sistema em equilíbrio, esquematize o Ki:
H2S H+ + HS–
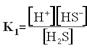 = constante de ionização do
= constante de ionização do
ácido H2S
HS– H+ + S2
![]() = constante de ionização do
= constante de ionização do
ácido HS–
Observação – Ki é de fundamental importância para medir a força de um eletrólito (ácido ou base). Assim, quanto maior for o valor do Ki, mais forte será o eletrólito.
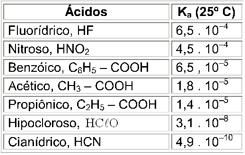
02. Os dados referem-se à temperatura de 25°C: