A Lei de Ostwald
Por Redação
Solução:
ácido cianídrico < ácido hipocloroso < ácido propiônico < ácido acético < ácido benzóico < ácido nitroso < ácido fluorídrico.
Relação entre Ki e (grau de ionização)
Observação – A lei de Diluição de Ostwald é valida principalmente para eletrólitos fracos (![]() < 5%) e moderados (5% <
< 5%) e moderados (5% <![]() < 50%), porém pode ser aplicado para eletrólitos fortes, desde que o
< 50%), porém pode ser aplicado para eletrólitos fortes, desde que o![]() não seja 100%.
não seja 100%.
A Lei de Ostwald
A adição de solvente a um eletrólito fraco ou moderado, ou seja, uma diluição, faz que seu grau de ionização ou dissociação aumente tendendo a 100%.
Expressão matemática da Lei de Ostwald: 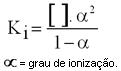
![]() = molaridade definida como .
= molaridade definida como . ![]()
Ki = constante de ionização.
Aplicação
(FEI–SP) Uma solução 0,1 molar de ácido acético apresenta ![]() = 1,35%. Determine, à mesma temperatura, o valor de µ para uma solução 0,01 molar do mesmo ácido.
= 1,35%. Determine, à mesma temperatura, o valor de µ para uma solução 0,01 molar do mesmo ácido.
Solução:
![]()
Observação – Para ![]() < 0,1, vamos desconsiderar o denominador.
< 0,1, vamos desconsiderar o denominador.
Ki = m.![]() 2
2
Ki = 0,1 . (0,0135)2
Ki = 1,82 . 10–5
Ki= m .![]() 2
2
1,82 . 10–5 = 0,01 .![]() 2
2
![]() = 4,27 . 10–2 ou = 4,27%
= 4,27 . 10–2 ou = 4,27%
Meio aquoso: equilíbrio iônico da água
Características da auto-ionização da água:
1. É muitíssimo pequena. De 555.000.000 de moléculas de água, somente uma se ioniza.
2. A concentração hidrogeniônica da água pura (destilada) é exatamente igual à concentração hidroxiliônica.
3. A água pura é um meio neutro.
4. A água pura é uma péssima condutora de íons na solução.
5. O grau de ionização da água pura vale 1,81 x 10-9 ou 1,81 x 10–7%.
6. a auto–ionização da água é um processo endotérmico.
Constante de equilíbrio iônico da água (Kw) ou produto iônico da água.
a) Dedução do Kw.
H2O(l)+ H2O(l)![]() H3O1+(aq) + OH1–(aq)
H3O1+(aq) + OH1–(aq)
No equilíbrio, V1 = V2.
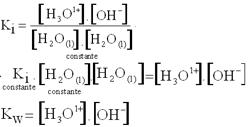
b) Cálculo do Kw a 20 – 25°C:
H2O(l)+ H2O(l) ![]() H3O 1+ (aq) + OH1–(aq)
H3O 1+ (aq) + OH1–(aq)
