Lei da Diluição de Ostwald
Por Redação
6. Lei de Diluição de Ostwald
Tomemos novamente o exemplo do ácido acético. Considere uma solução do ácido de M mols/litro, ou seja, a concentração em mol/L é igual a M.
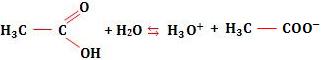
Temos:
![]()
Sendo α o grau de ionização do ácido, ocorrerá ionização de α M mols/litro do ácido, com formação de α M mols/litro de H3O+ e α M mols/litro de ![]() .
.
Se tínhamos M mols/litro do ácido e se ocorreu ionização de α M mols/litro, restaram (M – α M) mols/litro do ácido no equilíbrio.
Se aplicarmos a expressão de Ki para este equilíbrio, temos:
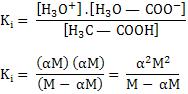
Se dividirmos por M o numerador e denominador, teremos:
![]()
Conclusão:
Quando a concentração M aumenta, o denominador (1 – α) deverá aumentar proporcionalmente, garantindo o valor constante de K1. Isto é, quando a concentração aumenta, α diminui, tendendo a zero, e se a concentração diminui, (1 – α) também deve diminuir, ou seja, α deve tender a 1.
Esta conclusão explica a Lei de Diluição de Ostwald:
“A uma dada temperatura, o aumento da concentração provoca diminuição do grau de ionização e, ao contrário, a diminuição da concentração provoca aumento do grau de ionização.”
