Nomenclatura dos oxoácidos
Por Redação
4. nomenclatura dos oxoácidos
– Oxoácidos com elementos centrais não- metálicos
Os oxoácidos são ácidos que contêm oxigênio.
A princípio é necessário ter o conhecimento da tabela abaixo:
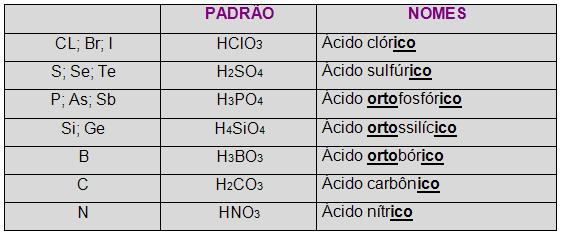
Observe que os ácidos-padrão em alguns casos têm o nome acompanhado por um prefixo (orto, grau máximo de hidratação).
Os demais ácidos nomeados decorrentes ao nome dos ácidos-padrão de cada uma das famílias, a organização é feita a partir de seis regras. Vejamos cada uma delas:
Regra 1 – terminação em ICO = padrão
*Maior número de oxidação.
Ex.: ácido telúrico- H2SO4
Substitui-se S por Te = H2TeO4
Regra 2 – terminação em OSO = padrão – um átomo de oxigênio.
*Menor número e oxidação.
Ex.: ácido bromoso- HClO3 Substitui-se Cl por Br, e retira-se um oxigênio = HBrO2
Regra 3 – inicia-se com HIPO,terminação em OSO = padrão – dois átomos de oxigênio.
*Menor de todos.
Ex.: ácido hipocloroso- HClO3
Retira-se 2 átomos de oxigênio = HClO
Regra 4 – inicia-se com PER terminação em ICO = padrão + um átomo de oxigênio.
*Maior de todos. Ex.: ácido perclórico- HClO3
Coloca-se um átomo de oxigênio = HClO4
Regra 5 – inicia-se com META = padrão – uma molécula de H2O.
*Grau mínimo de hidratação.
Ex.: ácido metafosfórico- H3PO4
Retira-se uma molécula de H2O = HPO3
Regra 6 – inicia-se com PIRO = 2x padrão – uma molécula de H2O.
*Grau intermediário de hidratação. Ex.: ácido pirofosfórico- H3PO4
O padrão é multiplicado por 2, retira-se uma molécula de H2O:
H3PO4 → (H3PO4) (x2) = H6P2O8 – H2O = H4P2O7
– Oxoácidos com elementos centrais metálicos


– Ácidos completos
Ácidos complexos são aqueles que contêm em sua fórmula íons complexos.
Por exemplo: ácido ferricianídrico:
![]()
