Estudo das bases
Por Redação
7. Estudo das bases
“base ou hidróxido é toda sustância que, dissolvida em água, se dissocia, fornecendo como ânion exclusivamente íons OH- (hidróxido)”
Definição de Arrhenius
Segundo Arrhenius, as bases devem possuir certas propriedades, como por exemplo: possuir sabor adstringente, conduzir eletricidade…
Por exemplo:
![]()
Nomenclatura
Se pensarmos em dar nome para uma base, através da fórmula geral
M (OH)x, temos:
M(OH)x – hidróxido de (nome de M)
Logo para cada fórmula abaixo temos:
NaOH → hidróxido de sódio
Ca(OH)2 → hidróxido de cálcio
Zn(OH)2 → hidróxido de zinco
Al(OH)3 → hidróxido de alumínio
NH4OH → hidróxido de amônio
Para indicar o maior e o menor número de oxidação, utilizam-se as terminações OSO e ICO:
CuOH → hidróxido cuproso
Cu (OH)2 → hidróxido cúprico
Fe (OH)2 → hidróxido ferroso
Fe (OH)3 → hidróxido férrico
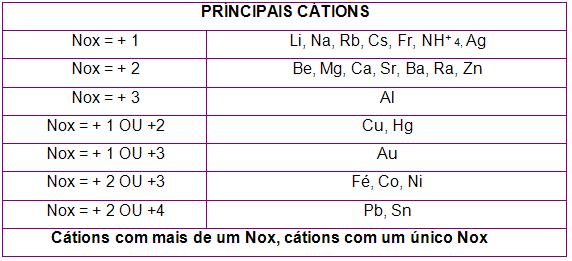
Tabela dos cátions
As bases são consideradas compostos iônicos, e quando estão em solução aquosa, elas se decompõem a partir disso se formam cátions diferentes de H+ e permanece o nome do metal, porém, se há dois números de oxidação acrescenta-se OSO ou ICO.
Vejamos alguns exemplos abaixo:
Na+ – cátion sódio
Cu1+ – cátion cobre I (cuproso)
Cu2+ – cátion cobre II (cúpriso)
Au1+ – cátion ouro I (auroso)
Au3+ – cátion ouro III (áurico)
Observe abaixo a tabela com os principais cátions

É importante lembrarmos que as bases compõem o Leite de magnésia, nos produtos de limpeza que são à base de amoníaco e também nos desentupidores. Lembrando que esses produtos citados fazem com que a fenolftaleína fique vermelha.
