O que são os Ácidos Arrhenius?
Por Victor Palandi
Os ácidos e bases, também conhecidos como álcalis, são substâncias químicas perigosas, capazes de corroerem até mesmo metais, como espécies de comprimidos efervescentes. Existem diversas definições para o assunto, das quais a mais utilizada é a de Arrhenius. A presença desses ácidos e bases em nossa vida cotidiana é muito mais comum e menos agressiva do que na verdade se imagina.
Resumo:
Definições de Arrhenius
A definição mais tradicional sobre ácidos e bases foi feita pelo cientista sueco Svante August Arrhenius, em 1887. Popularmente conhecido como dissociação iônica, em sua pesquisa, ele estabeleceu que os ácidos são substâncias que contém hidrogênio e que, em solução aquosa, liberam íons de hidrogênio (H+).
Como exemplos de ácidos, podemos citar o ácido clorídrico (HCL), encontrado em produtos de limpeza de pisos e soluções acidificantes para aquários de peixe ornamentais, por exemplo; ácido sulfúrico (H2SO4), muito utilizado em produção de detergentes e o ácido nítrico (HNO3), que em várias concentrações, é utilizado na fabricação de fertilizantes, corantes, fibras sintéticas, explosivos, etc.
As bases, também em solução aquosa, liberam hidroxilas, íons negativos (OH–). Como exemplos pode-se citar o hidróxido de sódio (NaOH), conhecido como soda cáustica, muito usado em indústrias para fabricação de papel, tecidos, alimentos e biodiesel; o hidróxido de potássio (KOH), usado na produção de sabões moles e fertilizantes, entre outras.
Ainda segundo a teoria de Arrhenius, se na molécula só existe um grupo hidróxido, é definido como monobase; se existem dois hidróxidos, diz-se dibase.
As restrições da teoria de Arrhenius
Porém, apesar da grande aceitação e de ser utilizada por químicos, a teoria de Arrhenius sofreu muitas restrições, por ele não conseguir explicar certas observações experimentais. Uma delas foi à de compostos químicos derivados da piridina possuir acentuado caráter básico, já que era óbvio que o caráter básico de um composto não poderia estar ligado ao seu poder de liberar íons de hidróxido, uma que a piridina não os possui.
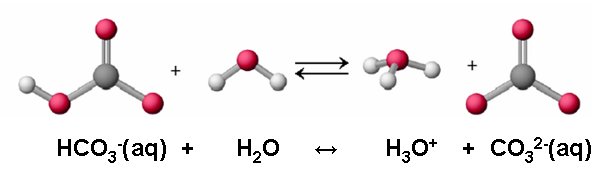
Outra limitação de sua teoria foi o fato de não poder explicar a neutralização de ácidos solventes não aquosos.
Outra definição de ácidos e bases
Outra definição para ácidos e bases foi conceituada por dois físicos-químicos: o dinamarquês Johannes N. Bronsted e o inglês Thomas Lowry, conhecida como “definição protônica”. A definição de Bronsted-Lowry é mais abrangente que a de Arrhenius, principalmente pelo fato de que nem todas as substâncias que se comportam como bases liberaram uma hidroxila OH-.
