Ponto Triplo
Por Redação
7. Ponto Triplo
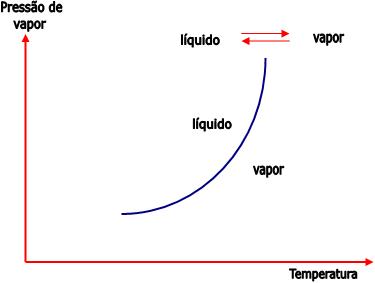
1) Equilíbrio líquido – vapor
Em cada temperatura há uma determinada pressão exercida pelo vapor em equilíbrio com o seu líquido.
2) Equilíbrio sólido – líquido
Um sólido pode estar em equilíbrio com o seu líquido, sob determinada pressão e temperatura.
![]()
Para que ocorra esse equilíbrio é necessária uma determinada temperatura para cada valor da pressão.
Seja o equilíbrio:
![]()
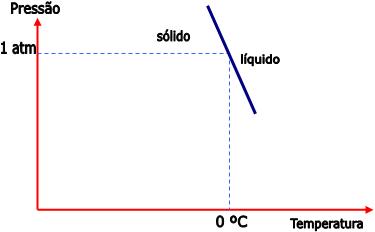
Sabemos que a densidade da água sólida é menor do que da água líquida. Portanto, o aumento da pressão transfere o equilíbrio para a direita, e isto quer dizer que a fusão do sólido torna-se mais fácil. Logo, para manter o equilíbrio, é necessário abaixar a temperatura quando a pressão aumentar.
Veja no gráfico abaixo, a curva que representa o equilíbrio da água:
3) Equilíbrio sólido – vapor
Chamamos de sublimação a passagem do estado sólido para o estado gasoso. O processo inverso recebe o nome de ressublimação ou deposição.
Dependendo das condições de pressão e temperatura, pode ocorrer o seguinte equilíbrio:
![]()
O aumento da pressão transfere o equilíbrio para a esquerda. Para manter o equilíbrio é necessária uma temperatura maior.

4) Ponto triplo – diagrama de fases
O diagrama de fases é uma representação gráfica das condições de pressão e temperatura de uma substância nos estados líquido, sólido e gasoso.
Veja abaixo o diagrama de fases para a água.
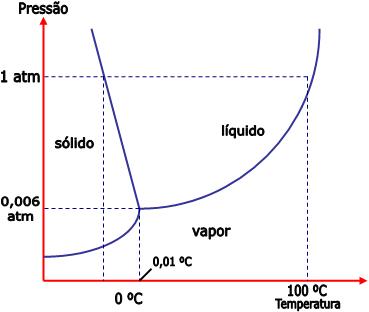
O gráfico está dividido em três áreas, cada uma delas representa uma fase pura. A linha cheia mostra as condições sob as quais duas fases podem existir em equilíbrio. O ponto triplo é onde as três curvas se encontram, é o ponto de equilíbrio entre as três fases.
O ponto triplo da água ocorre sob a temperatura 0,01°C e 0,006 atm. Apenas nessas condições, a água pode existir nas três fases em equilíbrio.
