Ebuliometria ou ebulioscopia
Por Redação
10. Ebuliometria ou ebulioscopia
Ebuliometria é o estudo do aumento da temperatura de ebulição de um solvente quando nele se dissolve uma substância não-volátil.
A variação da temperatura de ebulição ocorre com a variação da pressão externa.
Ao adicionar um soluto não-volátil a um solvente líquido, também ocorre a elevação da temperatura de ebulição. O soluto não-volátil dificulta a evaporação das moléculas, consumindo a sua energia cinética.
Lei de Raoult: A elevação do ponto de ebulição de um líquido, pela dissolução de uma substância não-volátil (dando solução molecular), é diretamente proporcional à concentração da solução em mol por quilograma de solvente.
∆te = Ke . Mm
Onde:
∆te: elevação da temperatura de ebulição
Ke: constante ebuliométrica (característica do solvente)
Para solução eletrolítica:
∆te = Ke . Mm . i
Cálculo da constante ebuliométrica
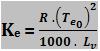
Te0 = temperatura absoluta de ebulição do solvente (K)
Lv = calor latente de vaporização do solvente (cal/g)
R = constante dos gases perfeitos = 2 cal/mol . K
