Soluções ácidas, básicas e neutras
Por Redação
2. Soluções ácidas, básicas e neutras
Água pura e solução neutra
A ionização de uma molécula de água gera um íon hidroxônio e um íon hidróxido. Logo, em água pura, a concentração hidrogeniônica é igual à concentração hidroxilônica.

Solução ácida
Ao dissolver um ácido na água ocorre o aumento da concentração hidrogeniônica.
Exemplo:
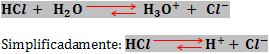
Sabendo que o produto [H+] .[OH–] é constante, se [H+] aumentar, logo [H–] diminui.
“Um meio é ácido quando [H+] > [OH–]”.
A 25°C, teremos em um meio ácido:
[H+] > 1 x 10-7 mol/L
[OH–] < 1 x 10-7 mol/L
Por exemplo, se num meio ácido em que, a 25°C, [H+] = 1 . 10-4 mol/L e [OH–] = 1 . 10-10 mol/L terá caráter ácido.
Solução básica ou alcalina
Ao dissolver uma base na água, ocorre um aumento da concentração hidroxiliônica.
Exemplo:
![]()
Sabendo que o produto [H+] . [OH–] é constante, se [OH–] aumentar, logo [H+] diminui.
“Um meio é básico ou alcalino quando [OH–] > [H+]”.
A 25° C, teremos em um meio ácido:
[OH–] > 1 . 10-7 mol/L
[H+] < 1 . 10-7 mol/L
Por exemplo, se num meio em que, a 25°C, [OH–] = 1 . 10-3 mol/L e [H+] = 1 . 10-11 mol/L terá caráter básico.
Resumidamente, a 25°C, temos:
soluções [H3O+] = 1 . 10-7 mol/L
neutras [OH–] = 1 . 10-7 mol/L
soluções [H3O+] > 1 . 10-7 mol/L
ácidas [OH–] < 1 . 10-7 mol/L
soluções [H3O+] < 1 . 10-7 mol/L
básicas [OH–] > 1 . 10-7 mol/L
Lembre-se que a 25°C:
[H3O+] . [OH–] = 1,0 x 10-14
