Balanceamento de equações pelo método redox
Por Redação
8.a O nox dos calcogênios (O, S, Se, Te, Po), quando estão na extremidade mais eletronegativa (direta), vale –2. Quando estão em outra posição, o nox é variável.
Ex:
![]()
Obs.: na pirita (FeS2), embora o enxofre esteja na extremidade mais eletronegativa, seu nox não é –2 e sim –1.
![]()
Balanceamento de equações pelo método redox:
Princípio Básico.
1.° Calcular o nox de cada elemento na equação, ultilizando as regras para o cálculo do nox.
2.° Verificar quem varia o nox de um lado para outro na reação e traçar os ramais oxi-red.
3.° Montar dois quadros. Um para oxidação e outro para redução. É necessário que a substância candidata a ir para um dos quadros não tenha nox repetido na equação. Caso ambas as substâncias não tenham nox repetido na equação, vai para o quadro, na seguinte sequência:
1) A substância de maior atomicidade (é o número de átomos do elemento que constitui a substância).
2) A substância de maior número de elementos diferentes.
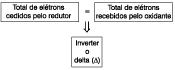
4.° Calcular, inverter e se possível simplificar o delta ( ![]() ).
).
Obs.: Cálculo do delta (![]() ).
).
![]()
5.° Prosseguir o balanceamento por tentativa sendo que o último elemento a ser balanceado é o oxigênio, e o penúltimo o hidrogênio.
