Equivalente-grama
Por Redação
1. Equivalente-grama
Chamamos de equivalente-grama as massas que se equivalem quimicamente, pois mesmo sendo numericamente diferentes, apresentam o mesmo poder de combinação.
Veja os exemplos com reações de neutralização:
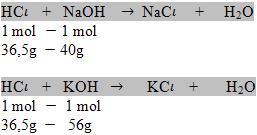
Como você pode notar no exemplo acima as massas 40g de NaOH e 56g de KOH, mesmo sendo numericamente diferentes, apresentam o mesmo poder de combinação, pois ambas combinam com uma massa de HCl (36,5g).
Portanto:
36,5g de HCl de equivalente-grama do HCl40g de NaOH de equivalente-grama do NaOH
56g de KOH de equivalente-grama do KOH
Considerando que são massas equivalentes, logo:
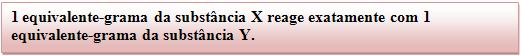
Portanto:

Deste modo:
36,5g de HCl (1eq. g) reagem com 40g de NaOH (1 eq.g)
73,0g de HCl (2 eq. g) reagem com 80g de NaOH (2 eq.g)
A massa de H2SO4 que reagem com 40g de NaOH (1 eq.g)
será o equivalente-grama do H2SO4.
Veja o cálculo abaixo:
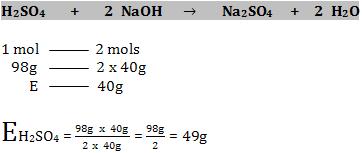
Vamos analisar o quociente ![]()
Numerador: massa molar do H2SO4
Denominador: número de átomos de hidrogênio ionizáveis (2).
Generalizando, temos:
![]()
Considerando um ácido, k é o número de átomos de hidrogênio ionizáveis. Considerando as outras substâncias, podemos realizar uma observação parecida para encontrar a fórmula que dá o equivalente-grama.
