Influência da pressão no ponto de fusão
Por Redação
Influência da pressão no ponto de fusão
Para a maioria das substâncias, a fusão tem por fim aumentar o seu volume, e como já vimos anteriormente, quando o volume tende aumentar, conseqüentemente, a pressão tende a diminuir o volume das substâncias.
Com base na Lei de Chatelier, podemos concluir que com o aumento de pressão, irá dificultar a fusão, ou seja, aumenta a temperatura de fusão.
Portanto, se pensarmos no gráfico da pressão em função da temperatura de fusão, pode-se dizer que a curva será crescente.
Vejamos este gráfico: 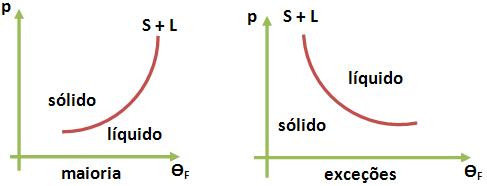
Esta curva também é conhecida como curva de equilíbrio sólido-líquido:
Olhando os gráficos acima, podemos observar que para as exceções (H2O, Fe, Bi, Sb), a fusão tem por “objetivo” diminuir o volume de cada uma delas, portanto quando a pressão aumenta conseqüentemente o volume tende a diminuir. Logo para as exceções, se a pressão aumentar, ela irá favorecer a fusão, diminuindo assim a temperatura de fusão. Portanto, a curva de equilíbrio sólido-líquido será decrescente.
Vejamos um exemplo:
* O que explica o grande deslocamento das geleiras, é o aumento da pressão e a diminuição da temperatura de fusão, pois o gelo se aglomera até determinada altura, fazendo com que a pressão na parte inferior aumente. Portanto, o que explica o deslizamento das geleiras é o aumento da pressão que causa a fusão do gelo.
