Modelos atômicos
Por Redação
12. Modelos atômicos
Demócrito
Há muito tempo atrás, cerca de aproximadamente 350 anos antes de Cristo, o filósofo grego Demócrito já afirmava que a matéria era formada por partículas muito pequenas e as denominou átomos, que significa (em grego) indivisível, ele dizia que a terra, o fogo, a água e o ar, eram elementos de extrema importância e fundamentais, pois eram a partir dos seus átomos se criava inúmeras matérias.
Porém, sua teoria foi aceita por Aristóteles, que era adepto de que a matéria é contínua.
Modelo de Dalton
Por volta de 1803, Dalton apresentou algumas idéias, que diziam que todas as propriedades da matéria, poderiam ser explicadas através do comportamento das partículas unitárias. Ele dizia que o átomo é uma partícula fundamental, sendo assim a menor partícula da matéria.
A partir dai o modelo de Dalton “ganhou vida”, ou seja, através dos átomos observados como pequenas esferas, indestrutíveis. Neste caso todos os átomos do elemento seriam iguais.
Modelo de Thomson
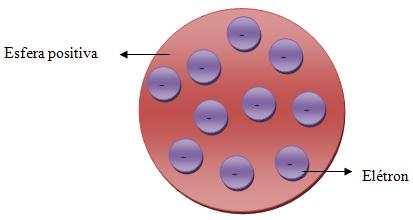
Por volta de 1897, Thomson mostrou que dava para explicar os raios catódicos, como um feixe formado por partículas carregadas, denominadas elétrons. Como podemos observar na ilustração acima, o modelo atômico de Thomson é em forma de esfera positiva, onde todos os elétrons ficam distribuídos igualmente.
O Modelo nuclear
Rutherford, um físico britânico. Realizou um trabalho em física nuclear e sua teoria da estrutura atômica, descreve o átomo como um núcleo denso rodeado de elétrons.
Identificou os três componentes principais da radiação e denominou-os raios alfa, beta e gama. Também demonstrou que as partículas alfa são núcleos de hélio.
Em 1919, dirigiu um importante experimento, durante o qual bombardeou nitrogênio com partículas alfa e obteve átomos de um isótopo do oxigênio, além de prótons. Esta transmutação foi a primeira a produzir uma reação nuclear de forma artificial.
Modelo de Bohr
A teoria atômica de Bohr, partiu do modelo atômico de Rutherford, segundo o qual o átomo é formado por um núcleo compacto cercado por uma nuvem de elétrons mais leves. O modelo de Bohr fez uso da teoria quântica e da constante de Planck, para estabelecer que um átomo emite radiação eletromagnética apenas quando um elétron salta de um nível quântico para outro. Esse modelo foi fundamental para os desenvolvimentos futuros da física atômica teórica.
Bohr deduziu q como o elétron só pode ocupar determinadas órbitas, as transições eletrônicas (ida e volta do elétron) ocorrem em número restrito, o que produz somente alguns tipos de radiação eletromagnética e não todas como no espectro contínuo.
Alguns postulados que o levaram a essa conclusão são:
– na eletrosfera os elétrons não se encontram em qualquer posição. Eles giram ao redor do núcleo em órbitas fixas e com energia definida. As órbitas são chamadas camadas eletrônicas, representadas pelas letras K, L, M, N, O, P e Q a partir do núcleo, ou níveis de energia representados pelos números 1, 2, 3, 4…;
– os elétrons ao se movimentarem numa camada eletrônica não absorvem nem emitem energia;
– os elétrons de um átomo tendem a ocupar as camadas eletrônicas mais próximas do núcleo, isto é, as que apresentam menor quantidade de energia;
– um átomo está no estado fundamental quando seus elétrons ocupam as camadas menos energéticas;
– quando um átomo recebe energia (térmica ou elétrica), o elétron pode saltar para uma camada mais externa (mais energética). Nessas condições o átomo se torna instável. Dizemos que o átomo se encontra num estado excitado;
– os elétrons de um átomo excitado tendem a voltar para as camadas de origem. Quando isso ocorre, ele devolve, sob a forma de onda eletromagnética, a energia que foi recebida na forma de calor ou eletricidade.
