Força básica das aminas
Por Redação
9 – Força básica das aminas
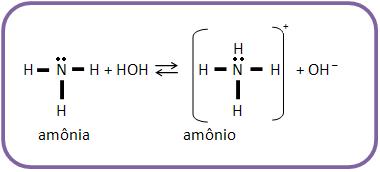
As aminas, assim como o amoníaco, apresentam reação alcalina em solução aquosa e podem se fixar à um próton, por terem um par de elétrons não-compartilhado do nitrogênio.

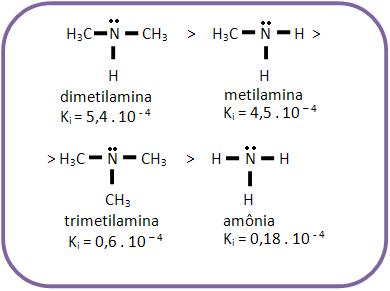
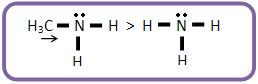
As bases mais fortes que o amoníaco são denominadas aminas alifáticas, pelo fato da afinidade do nitrogênio por próton aumentar por causa do efeito elétron-repelente dos grupos alquila. O próton é atraído com maior intensidade devido o aumento da densidade eletrônica N.
A trimetilamina é mais fraca que a metilamina e a dimetillamina, mesmo apresentando 3 grupos – CH3 elétron-repelentes, devido a um impedimento espacial (efeito estérico).
Os grupos – CH3 dificultam o ataque do próton ao par eletrônico do nitrogênio.