Periodicidade das configurações eletrônicas
Por Redação
1. Periodicidade das configurações eletrônicas
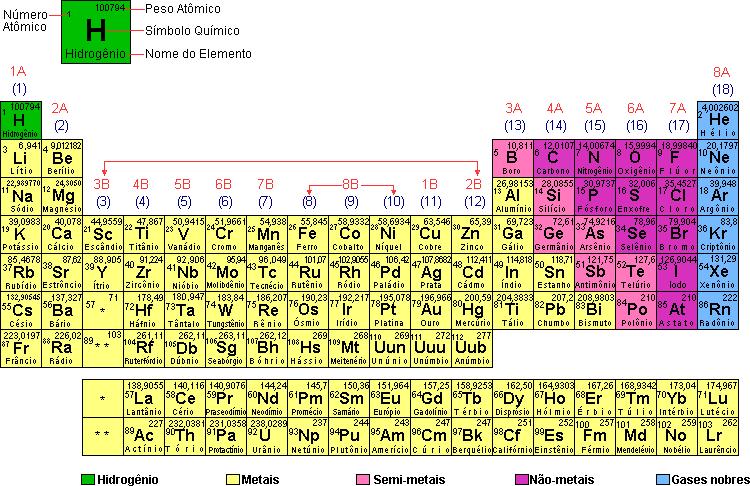
O que é tabela periódica?
Observação – O elemento hidrogênio, por apresentar diferenças em relação aos demais elementos de seu grupo, não pertence a família 1A (ou 1).
Famílias B (3B a 2B) ou 3, 4, 5, 6, 7, 8, 9, 10, 11, 12
Abrangem os elementos chamados de transição.
O último nível desses elementos geralmente apresenta dois elétrons, e o penúltimo de nove a dezoito elétrons (nível em transição crescente).
Exemplos:
a) Escândio (Sc; 21): 2-8-9-2 (3B ou 3)
b) Titânio (Ti; 22): 2-8-10-2 (4B ou 4)
c) Ferro (Fe; 26): 2-8-14-2 (8B ou 8)
Observações:
1. As famílias 1B (ou 11) e 2B (ou 12) são casos particulares, pois, embora possuam a configuração eletrônica de elementos representativos, apresentam propriedades químicas de elementos de transição.
2. Note que a primeira família é 3B para que haja concordância do número da família com a valência do elemento químico.
Elementos de transição interna: lantanídeos e actinídeos
O último nível dos elementos de transição interna geralmente apresenta dois elétrons, e o penúltimo oito. O antepenúltimo cresce de 19 a 32 elétrons (nível interno em transição crescente).
Exemplos:
a) Cério (Ce; 58): 2-8-18-20-8-2
b) Prasiodímio (Pr; 59): 2-8-18-21-8-2
c) Plutônio (Pu; 94): 2-8-18-32-24-8-2
O elemento de transição interna mais importante é o urânio, usado nos reatores atômicos para produção de energia elétrica, o qual substitui quantidades fantásticas de petróleo.
Diferenciação dos três tipos de elementos por meio do último subnível
Elementos representativos
Podem terminar em subnível do tipo s (1A e 2A) ou do tipo p (3A a 8A), ambos pertencentes ao último nível de cada átomo (nível em crescimento).
Exemplos:
1) 12Mg: 1s2 2s2 2p6 3s2 (período 3 e família 2A ou 2)
2) 18Ar: 1s2 2s2 2p6 3s2 3p6 (período 3 e família 8A ou 18)
Observe a tabela abaixo que contém a configuração dos vinte primeiros elementos da tabela.
|
Elemento |
Z |
Configuração |
Número de elétrons na camada de valência |
|
Hidrogênio |
1 |
1s1 |
1 |
|
Hélio |
2 |
1s2 |
2 |
|
Lítio |
3 |
1s2 2s1 |
1 |
|
Berílio |
4 |
1s2 2s2 |
2 |
|
Boro |
5 |
1s2 2s2 2p1 |
3 |
|
carbono |
6 |
1s2 2s2 2p2 |
4 |
|
Nitrogênio |
7 |
1s2 2s2 2p3 |
5 |
|
Oxigênio |
8 |
1s2 2s2 2p4 |
6 |
|
Flúor |
9 |
1s2 2s2 2p5 |
7 |
|
Neônio |
10 |
1s2 2s2 2p6 |
8 |
|
Sódio |
11 |
1s2 2s2 2p6 3s1 |
1 |
|
Magnésio |
12 |
1s2 2s2 2p6 3s2 |
2 |
|
Alumínio |
13 |
1s2 2s2 2p6 3s2 3p1 |
3 |
|
Silício |
14 |
1s2 2s2 2p6 3s2 3p2 |
4 |
|
Fósforo |
15 |
1s2 2s2 2p6 3s2 3p3 |
5 |
|
Enxofre |
16 |
1s2 2s2 2p6 3s2 3p4 |
6 |
|
Cloro |
17 |
1s2 2s2 2p6 3s2 3p5 |
7 |
|
Argônio |
18 |
1s2 2s2 2p6 3s2 3p6 |
8 |
|
Potássio |
19 |
1s2 2s2 2p6 3s2 3p6 4s1 |
1 |
|
Cálcio |
20 |
1s2 2s2 2p6 3s2 3p6 4s2 |
2 |
A partir dessa tabela concluímos que, o neônio – Z = 10 e o argônio – Z = 18, contém 8 elétrons no último nível. Já o nitrogênio – Z = 7 e o fósforo – Z 15, possuem 5 elétrons no último nível.
Podemos perceber que as configurações se repetem, depois de um intervalo de 8, isso ocorre conforme o número atômico aumenta.
Portanto podemos chegar à conclusão de que a configuração eletrônica é considerada uma função periódica de todos os números atômicos.
