Lei de Guldberg Waage
Por Redação
2. Natureza de reagentes e produtos
Quanto maior o n.° de ligações a serem rompidas nos reagentes e quanto mais fortes forem essas ligações, mais lenta será a reação, e vice-versa.
2NO + O2 2NO2 (reação moderada a 20°C).
CH4 + 2O2 CO2 + 2H2O (muito lenta 20°C).
3. Luz
Acelera reações fotoquímicas.
no escuro
Ex.: H2(g) + Cl2(g) 2HCl(g) (reação muito lenta)
Luz
H2(g) + Cl2(g) 2HCl(g) (reação Rápida)
4. Pressão
O aumento da pressão num sistema que contém pelo menos um participante gasoso, implica em diminuir o volume do sistema, aumentando o n.° de colisões entre os reagentes e, conseqüentemente, a velocidade da reação. 
5. Temperatura
O aumento da temperatura faz aumentar a agitação molecular, a energia cinética, o número de partículas com energia maior ou igual à energia de ativação, o número de choques, aumentado a velocidade da reação.
Observação: O aumento da temperatura, aumenta a velocidade de reações endotérmicas e exotérmicas.
6. Catalisadores
Substâncias que aumentam a velocidade da reação porque diminuem a energia de ativação necessária para que os reagentes se transformem no complexo ativado.
Observação – Podem participar de uma etapa da reação, porém são totalmente restituídos no fim da mesma.
Exemplo: Enzimas.
Gráficos de velocidade de uma reação
I – Concentração dos reagentes diminuem com o tempo.
II – Concentração dos produtos aumentam com o tempo.
III – Velocidade diminui, pois V = K. [R}
7. Concentração de reagentes e produtos
Ao aumentar a concentração de reagentes, aumenta-se o número de choques, a probabilidade de a colisão ser efetiva, aumentando a velocidade da reação.
Lei de Guldberg Waage (Lei da ação das massas)
“A velocidade de uma reação é diretamente proporcional ao produto das concentrações molares dos reagentes, quando estes estão elevados a expoentes, que são os seus respectivos coeficientes estequiométricos”.
Exemplo: aA + bB cC + dD
V = K . [A]a . [B]b
K é uma constante que só depende da temperatura, e a e b são os expoentes determinados experimentalmente.
Determinação experimental da equação da velocidade da reação
A + B ![]() X
X
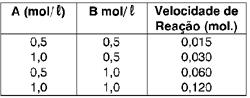
Para determinar, experimentalmente, a lei da velocidade, devemos variar a concentração molar dos reagentes e verificar como varia a velocidade.
Do experimento 1 para o experimento 2,
A [A] foi dobrada e [B] manteve-se constante. A velocidade também foi dobrada. Dessa forma, concluímos que o coeficiente de [A] é 1.
Do experimento 1 para o 3, [A] permaneceu constante e [B] foi dobrada. E a velocidade quadriplicou. Concluímos, então, que o coeficiente de [B] é 2 e a lei da velocidade é:
V = K . [B]1 . [B]2
