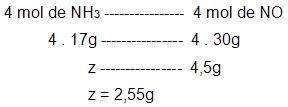Cálculos estequiométricos em reações consecutivas
Por Redação
4. Cálculos estequiométricos em reações consecutivas
Para que possamos criar uma relação entre as quantidades de matéria de substâncias existentes nas reações consecutivas, é preciso que as equações químicas tenham uma substância em comum entre elas, apresentando assim coeficientes iguais nas equações.
Vejamos um por exemplo:
O ácido nítrico surge a partir e algumas reações observem a equação dessas reações.
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 2NO + O2 → 2NO2
3) 3NO2 + H2O → 2HNO3 + NO
Agora, para calcular a massa da amônia é preciso para que ocorra a preparação de 6,3 gramas de ácido nítrico.
Dado:
Massas molares em g/mol:
NH3: 17
HNO3: 63
NO2: 46
NO: 30
Vejamos a resolução:
NH3, está presente na reação 1).
HNO3, está presente na reação 3).
NO, participa das reações 1) e 2).
NO2, está presente nas reações 2) e 3).
Efetuando a multiplicação da equação 2) por 2, e a equação 3) por 4/3, obteremos:
1) 4NH3 + 5O2 → 4NO + 6H2O
2) 4NO + 2O2 → 4NO2
3) 4NO2 + 4/3H2O → 8/3HNO3 + 4/3NO
É possível conseguir 8/3 mols de HNO3, a partir de 4 mols NH3.
Vejamos:
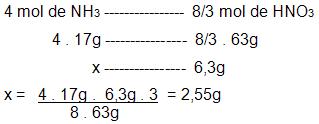
Resolução do problema sem executar o balanceamento da equação
– calculo da quantidade de NO2 que será preciso para adquirir 6,3g de HNO3.
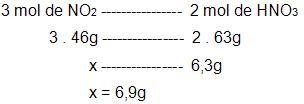
– cálculo da quantidade de NO que será preciso para adquirir 6,9g de NO2.
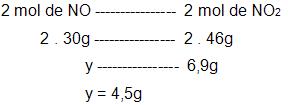
– cálculo da quantidade de NH3 que será preciso para adquirir 4,5g de NO.