Propriedades Periódicas dos Elementos
Por Redação
Propriedades periódicas dos
elementos
São aquelas cujos valores numéricos crescem ou decrescem em função do número atômico crescente.
Vejamos as principais propriedades periódicas:
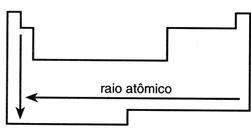
Raio atômico – O raio de um átomo é uma propriedade difícil de ser determinada, pois a eletrosfera de um átomo não tem fronteira definida.
O raio atômico de um elemento depende de dois fatores:
a) Número de níveis eletrônicos (camadas): numa família, quanto maior o número atômico, maior é o raio atômico.
b) Carga nuclear (número atômico): num período, quanto maior o número atômico, menor é o raio atômico.
I ônico – Para íons isoeletrônicos (iguais números de elétrons), o de menor número atômico será o maior, pois apresenta menor atração entre o núcleo e os elétrons.
8O2– > 9F1– > 11Na1+ > 12Mg2+
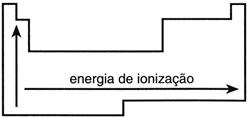
Potencial de ionização – É a energia necessária para remover um elétron de um átomo isolado no estado gasoso. À medida que aumenta o tamanho do átomo, aumenta a facilidade para a remoção de um elétron de valência. Portanto, quanto maior o tamanho do átomo, menor o potencial de
ionização.
Li(g) ![]()
Li+(g) + 1e– 1.ºPI = 124kcal/mol
Li+(g) Li++(g) + 1e– 2.ºPI = 1744kcal/mol
Li++(g) Li+++(g) + 1e– 3.ºPI = 2823kcal/mol
1.º PI < 2.º PI < 3.º PI <…
Eletronegatividade – É a propriedade pela qual o átomo apresenta maior tendência a ganhar elétrons. Esta propriedade depende de dois fatores: número de elétrons na última camada e tamanho do átomo.
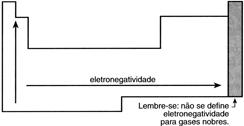
O cientista Linus Pauling propôs uma escala de valores para a eletronegatividade:
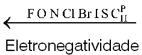
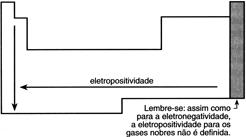
Eletropositividade – É a propriedade pela qual o átomo apresenta maior tendência a perder elétrons. Evidentemente, esta propriedade é o inverso da eletronegatividade.