Relações entre a estrutura atômica e a posição do elemento na classificação periódica
Por Redação
4- Relações entre a estrutura atômica e a posição do elemento na classificação periódica
Nos subgrupos A, 1 – B e 2 – B, os elementos indicam números de elétrons na camada de valência idêntico ao número do grupo. No grupo A os elementos são denominados representativos ou típicos, o último elétron que se acrescenta na eletrosfera se localiza no subnível s ou p. Observe o exemplo:
Mg (2 – A ou 2), possui 2 elétrons externos.
Cu (1 – B ou 11) possui 1 elétron mais externo.
Nos subgrupos 3 – B, 4 – B, 5 – B, 6 – B, 7 – B e 8 – B, apresentam 1 ou 2 elétrons na camada mais remota. O subnível d incompleto é denominado metais de transição, como por exemplo, o ferro: Vejamos:
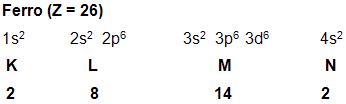
Vejamos agora algumas características específicas dos metais de transição:
• Eles apresentam mais de um número de oxidação pelo fato de tanto os elétrons da camada mais externa, como os dos orbitais d incompletos, fazerem parte da combinação. Dessa forma os íons Fe++ e Fe+++, possuem a seguinte distribuição eletrônica:
Fe++: 1s2 2s2 2p6 3s2 3p6 3d6
Fe+++: 1s2 2s2 2p6 3s2 3p6 3d5
O limite dessa variabilidade de valência varia entre superior e inferior. O limite superior é dado pelo mesmo número do grupo que ele faz parte, e o limite inferir é dado pelo número de elétrons encontrados no subnível s periférico, e de maneira geral são 2, menos para o grupo 6 – B neste caso o número é 1.
Dentre os limites superiores e inferiores existe uma camada de valência intermediaria em que o elemento pode apresentar o esquema abaixo:
|
Grupo |
3-B |
4-B |
5-B |
6-B |
7-B |
8-B |
|
Limite inferior |
2 |
2 |
2 |
1 |
2 |
2 |
|
Intermediários |
3 |
3 |
2 |
3 |
3 |
|
|
Limite superior |
3 |
4 |
5 |
6 |
7 |
8 |
• Eles formam facilmente complexos, como por exemplo, o Ferricianeto de potássio ( K3 [ Fe (CN)6 ] ) e o Ferrocianeto de potássio (K4 [ Fe (CN)]).
• Eles apresentam em soluções aquosas, e íons coloridos, observe o exemplo:
Fé+++ – vermelho ferrugem
Fé++ – verde
• Na camada de valência eles apresentam 1 ou 2 elétrons. Os metais de transição interna são os actinídeos (referente a ocupação do subnível 5f, encontra-se no subgrupo 3 – B) e os lantanídeos (referente a ocupação eletrônica do subnível 4f, encontra-se no subgrupo 3 – B), por exemplo:
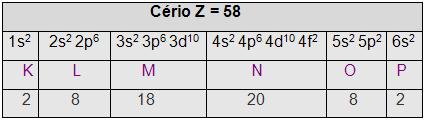
Elementos do grupo zero, indicam eletronicamente completos todos os subníveis iniciados, os gases nobres fazem parte desse grupo (zero),e possui 8 elétrons na camada K, porém os compostos de gases sintetizados não são em sua totalidade inertes, por exemplo: X e F4, X e O3, entre outros.
Observe abaixo o resumo das configurações eletrônicas, sendo o número quântico principal (n).

Notas:
1– Com relação ao cobre, ouro e prata, um dos elétrons do subnível ns2, irá passar para o subnível (n – 1) d9, contradizendo a regra de preenchimento. dessa forma o cobre (Z = 29) deve ter a seguinte distribuição:
1s2 2s2 2p6 3s2 3p6 3d9 4s2
Porém sua configuração é:
1s2 2s2 2p6 3s2 3p6 3d10 4s1
2- Uma das exceções do Diagrama de Linus Pauling, ocorre quando o cromo e molibdênio (grupo 6 – B), um elétrons do subnível ns2 transporta-se para o subnível (n – 1) d4. Cromo estaria com configuração de:
1s2 2s2 2p6 3s2 3p6 3d4 4s2
Mas sua configuração é :
1s2 2s2 2p6 3s2 3p6 3d5 4s1
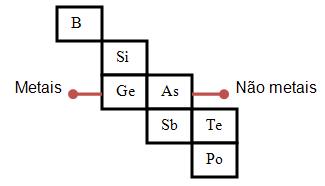
3- Existem os semimetais ou metalóides, que estão entre os metais e os não-metais, por exemplo, o silício e o germânio, eles também podem ser utilizados na fabricação de transistores.

Silício
