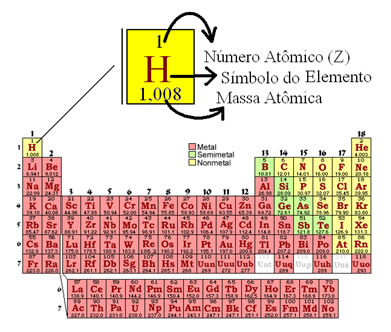
Número Atômico e Número de Massa
Descubra o que é Número Atômico e Número de Massa.
Por Redação
, atualizado em
Tomando o modelo de Rutherford–Bohr como objeto de estudo, podemos definir alguns tópicos básicos que vão nortear nossos estudos.
a) Número atômico (Z): n.° de prótons (P) no núcleo de um átomo.
O número atômico caracteriza um elemento químico.
b) Número de massa (A): O número de massa é a soma dos prótons (P) e nêutrons (N) do núcleo de um átomo.
A = P + N ou A = Z + N
Um átomo (X) será representado assim:
AzX ou zXA
Átomo neutro
Aquele em que o número de prótons é igual ao número de elétrons.
Exemplo: 11Na23 e 8O16
Íon
Espécie química cujo número de prótons é diferente do número de elétrons.
Os cátions são formados por retiradas de um ou mais elétrons da eletrosfera de um átomo: íon carregado positivamente.
Exemplos:
2311Na1+ = perdeu 1 elétron
3517Cl1- = ganhou 1 elétron
Ânions
são formados quando adicionamos um ou mais elétrons à eletrosfera de um átomo: íon carregado negativamente.
Exemplos:
168O2- = ganhou 2 elétrons
3517Cl1- = ganhou 1 elétron
Isótopos
Átomos com o mesmo número atômico (número de prótons) e diferentes números de massa. Pertencem ao mesmo elemento químico. Os isótopos possuem propriedades químicas iguais e propriedades físicas diferentes.
Exemplo:
11H = Prótio ou hidrogênio leve
21H = Deutério
31H = Trítio
Isóbaros
Átomos com o mesmo número de massa (A). Os isóbaros possuem propriedades químicas e físicas diferentes.
Exemplo:
4019K e 4020Ca
Isótonos
Átomos com o mesmo número de nêutrons (N). Os isótonos possuem propriedades físicas e químicas diferentes.
Exemplo:
3717Cl e 4020Ca
Isoeletrônicos
Espécies químicas com o mesmo número de elétrons. Os isoeletrônicos possuem propriedades físicas e químicas diferentes.
Exemplo:
15P3 – e 20Ca2+ : ambos com 18 elétrons.