Análise gráfica da energia de ativação
Por Redação
8. Análise gráfica da energia de ativação
• Reação exotérmica
![]()
Graficamente, temos:
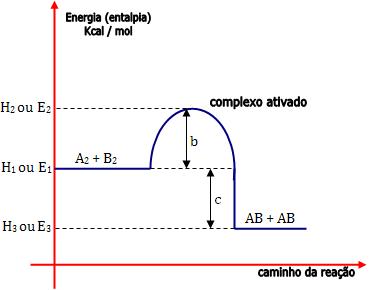
Onde:
E1 = energia própria dos reagentes
E2 = energia do complexo ativado
b = energia de ativação da reação direta R → P (E2 – E1)
b + c = energia de ativação da reação inversa P → R (E2 – E3)
c = ∆H (variação de entalpia) da reação (variação total da energia).
E3 = energia própria dos produtos
Note que E2 – E3 (b + c) > E2 – E1 (b).
• Reação endotérmica
![]()
Graficamente, temos:
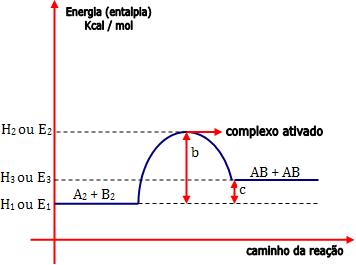
Onde:
E1 = energia própria dos reagentes
E2 = energia do complexo ativado
b = energia de ativação da reação direta (R → P)
b – c = energia de ativação da reação inversa (P →R)
c = ∆H (variação de entalpia) da reação (variação total da energia).
E3 = energia própria dos produtos
Note que E2 – E3 (b – c) < E2 – E1 (b).
O ponto mais elevado do gráfico refere-se ao momento da colisão entre as partículas ativadas.
