Tonometria ou Tonoscopia
Por Redação
8. Tonometria ou Tonoscopia
A tonometria estuda o abaixamento da pressão máxima de vapor de um solvente por adição de um soluto não-volátil.
Considere um cilindro ligado a um manômetro, contendo no seu interior um líquido puro (solvente). Considere outro cilindro, também ligado a um manômetro, só que contendo no seu interior um solvente misturado com um soluto X não-volátil (solução).
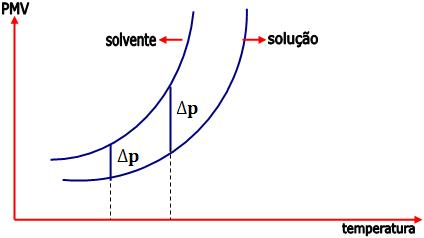
A partir desta experiência, vamos notar que a pressão de vapor da solução é menor que a do solvente puro, isto ocorre, pois as partículas do soluto X consomem a energia cinética das moléculas do solvente, não permitindo que parte destas receba o estado de vapor.
As partículas dispersas formam uma barreira, dificultando a movimentação das moléculas do solvente do líquido para a fase gasosa.
∆p = p – p’
Onde:
p: pressão máxima de vapor do solvente puro.
p’: pressão máxima de vapor do solvente na solução.
∆p: abaixamento da pressão máxima de vapor
O abaixamento da pressão máxima de vapor (∆p) depende da temperatura.
O quociente entre o abaixamento da pressão máxima de vapor (∆p) e a pressão máxima de vapor do solvente puro (p) é chamado de abaixamento relativo da pressão máxima de vapor.
![]()
O abaixamento relativo não depende da temperatura, pois a sua variação promove a variação de ∆p e p, de mesma magnitude, não influenciando no quociente, desde que o soluto seja não-volátil.
Lei de Raoult: “O abaixamento relativo da pressão máxima de vapor de um líquido, produzido pela dissolução de uma substância não-volátil (dando solução molecular), é diretamente proporcional à concentração da solução em mol por quilograma de solvente (Mm).”
![]()
Kt = constante tonométrica (característica do solvente)
![]()
Mm = concentração da solução em mol/kg.
![]()
n = quantidade de matéria do soluto.
A lei de Raoult só pode ser aplicada em soluções diluídas e moleculares. Para as soluções iônicas, como o abaixamento relativo da pressão máxima de vapor é uma propriedade coligativa , deve ser aplicado o Fator de Correção de Van’t Hoff (i).
![]()
