Conclusões de Van´t Hoff
Por Redação
12. Conclusões de Van’t Hoff
Van’t Hoff verificou uma relação de semelhança entre a pressão dos gases e a pressão osmótica das soluções diluídas. Baseado nas experiências de pressão osmótica do estudioso Pfeffer constatou-se uma semelhança com as leis dos gases de Boyle e de Charles:
“A pressão osmótica de uma solução é igual à pressão que o soluto exercia no estado gasoso, ocupando o mesmo volume da solução, na mesma temperatura.”
Portanto, podemos aplicar a equação dos gases perfeitos:

Equação da Pressão Osmótica
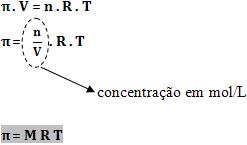
M = concentração em quantidade de matéria (mol/L)
R = constante dos gases perfeitos
T = temperatura absoluta
Para pressão em atmosfera, o valor de R será 0,082 atm . L . (mol . K)-1. E para pressão osmótica em milímetro de mercúrio, o valor de R será 62,3 mm Hg . L . (mol . K)-1.
Para soluções iônicas, devemos usar o fator de correção de Van’t Hoff:
i = α(q – 1) + 1
![]()
Como a pressão osmótica depende da concentração de partículas dispersas, é considerada uma pressão osmótica.
Chamamos de isotônicas as soluções com a mesma pressão osmótica. Quando as soluções osmóticas apresentam diferenças são denominadas anisotônica.
As soluções que apresentam intensa pressão osmótica são denominadas hipertônicas, e as soluções de pressão osmótica fraca são hipotônicas.
