pH e grau de ionização
Por Redação
4. pH e grau de ionização
Considere um ácido fraco genérico HkA. Ao dissolver M mols desse ácido em água, de maneira que forme 1 litro de soluçai, a concentração em mol/L e a normalidade serão:
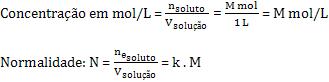
O grau de ionização do ácido é:
![]()
Logo, a quantidade em mols que ioniza = α . M.
Considere o equilíbrio da ionização:
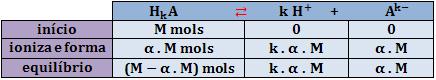
A concentração hidrogeniônica no equilíbrio final é:
![]()
Portanto: [H+] = α . N ou [H+] = α . k . M
Sendo que k é o número de hidrogênios ionizáveis.
