Substâncias Covalentes e Moleculares
Por Redação
, atualizado em
Ligações químicas
7N: 1s2 2s2 2p3 (5 elétrons na camada de valência).
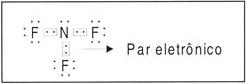
Fórmula de Lewis (eletrônica): são representados apenas os elétrons de valência.

b) 1H: 1s1
8O: 1s2 2s2 2p4
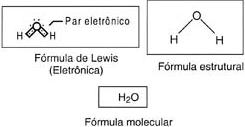
Nos exemplos, podemos notar que, na formação do par, cada átomo participa com 1 elétron. Quando o compartilhamento é feito dessa forma, dizemos que ocorreu uma ligação covalente comum. Observe agora o caso do monóxido de carbono (CO):
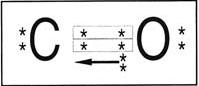
Note que há duas ligações covalentes comuns e uma outra representada por uma seta . Esse “novo” tipo de ligação é chamada de covalente coordenada ou dativa. A ligação dativa ocorre quando apenas um átomo contribui na formação do par .
Observação – A ligação dativa ocorre quando não há mais possibilidade de realização da covalente comum; então, o átomo isolado com oito elétrons na última camada, e que possui pares isolados, cede um par eletrônico para um outro átomo que precise receber dois elétrons.
Características das substâncias covalentes e moleculares.
Primeiramente, é importante diferenciar uma substância covalente de uma substância molecular.
1) Substância covalente – Sólido cristalino formado somente por ligações covalentes. Formam macromoléculas.
Exemplo: diamante C(n) e grafite C(n).
2) Substância molecular – São compostos que só apresentam ligações covalentes entre seus átomos, intramoleculares, mas não entre moléculas, intermoleculares.
Exemplo: H2O, H2SO4 e NO2
Propriedades dos compostos covalentes ou moleculares – Um composto é molecular quando sua estrutura apresentar apenas ligações covalentes.
– Não possuem íons; possuem moléculas.
– Baixa condução de corrente elétrica (exceto grafite) quando puras. No entanto, quando em solução aquosa, se houver formação de íons (ionização), passam a conduzir corrente elétrica.
– Podem ser sólidos, líquidos ou gasosos.
– Apresentam baixas temperaturas de fusão e de ebulição (não resistem ao calor).
– Geralmente, são insolúveis em água. A solubilidade em água vai depender da polaridade da molécula.
