Ligação iônica ou eletrovalente
Por Redação
3. Ligação iônica ou eletrovalente
Quando aparece a ligação iônica
A ligação iônica é baseada na atração eletrostática de dois íons com cargas opostas.
A ligação iônica aparece quando um átomo tem 1 a 3 elétrons na camada de valência, geralmente dos metais, esses átomos perdem elétrons, fazendo com que se transformem em cátions, sendo assim o número de elétrons ficará menor que o número de prótons.
1) Metais – São aqueles que possuem 1, 2 ou 3 elétrons na camada de valência. A tendência dos metais é perder esses elétrons.
Exemplos:
a) 19K:1s22s22p63s23p64s1
19K1+:1s22s22p63s2p6
b)20Ca:1s22s22p63s23p64s2
20Ca2+:1s22s22p63s23p6
2) Ametais – São aqueles que possuem 4, 5, 6 ou 7 elétrons na camada de valência. A tendência dos ametais é receber elétrons.
Exemplos:
a)16S:1s22s22p63s23p4
16S2–:1s22s22p63s23p6
b)9F:1s22s22p5
9F-:1s22s22p6
Apesar de estar na família 1A, o hidrogênio não é um metal, ou seja, não possui tendência de perder o seu único elétron. Na verdade, o átomo de hidrogênio tende a receber um elétron, ficando, assim, com configuração eletrônica igual à do gás nobre hélio. Como a perda de um elétron originaria um sistema sem elétrons, lembrando que o íon H+ não é estável no estado isolado.
A camada de valência dos não metais possuem mais de 4 elétrons, e são propensos a admitir elétrons. O composto é formado pela atração de íons positivos e negativos, que estão presos a atração eletrostática.
Observe:
Cloreto de potássio
Potássio: Z = 19
|
K |
L |
M |
N |
|
2 |
8 |
8 |
1 |
Cloro: Z = 17
|
K |
L |
M |
|
2 |
8 |
7 |
As ligações químicas também podem ser representadas pelo diagrama de Lewis, observe abaixo:
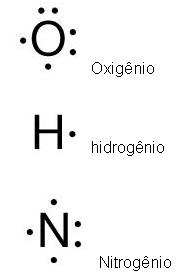
Esses pontos em volta dos símbolos são a representação dos elétrons da valência.
Observe como e possível alcançar a fórmula de um composto iônico:
O: Z = 8
|
K |
L |
|
2 |
6 |
Al: Z = 13
|
K |
L |
M |
|
2 |
8 |
3 |
1 átomo O ganha 2 e perde 2 Al +++
1 átomo Al ganha 3 e perde 3 O–
Fórmula: Al2 O3
Portanto o diagrama de Lewis
É importante lembrar que um composto iônico é sólido e cristalino quando está em circunstâncias ambientais. Por exemplo, íons de sódio, e cloreto, ambos possuem números iguais de íons.

Cristal de cloreto de sódio, ou seja, sal comum

 Substâncias Covalentes e Moleculares
Substâncias Covalentes e Moleculares