Como funciona a estequiometria?
O conceito químico da estequiometria aborda a quantidade de reagentes necessários para produção de novas substâncias (produtos). Entenda!
Por Victor Palandi
O conceito químico da estequiometria aborda a quantidade de reagentes necessários para produção de novas substâncias (produtos) formulando reações químicas a partir de equações correspondentes, referindo-se a uma “mistura perfeita”.
Quatro regras são essenciais para o cálculo estequiométrico:
- Escrever a equação química do processo. Ex: CO + O² > CO²;
- Acertar os coeficientes estequiométricos da equação química (balancear a equação). Ex: 2CO + O² > 2CO²;
- Montar a proporção da equação a partir dos dados apresentados no problema, atentando se você terá relações massa-massa, massa-mols, massa-volume, etc. A quantidade de átomos dos reagentes deve ser sempre igual à quantidade de átomos dos produtos. Essa proporcionalidade também se aplica para as massas moleculares (mols) de uma substância;
- Utilizar regra de três para chegar ao resultado proposto.
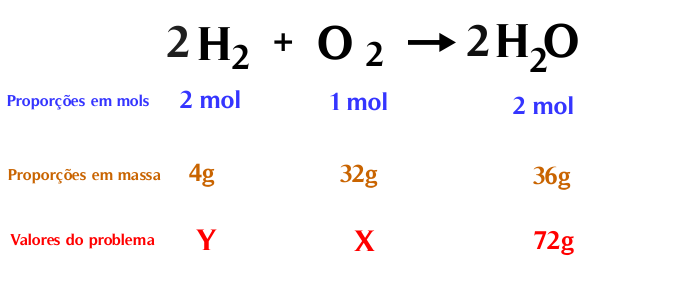
Além do processo simples, é necessário atentar a alguns outros conceitos. As reações químicas obedecem a três leis:
- A Lei de Lavoisier fala que, numa reação química em um sistema fechado, a soma das massas dos reagentes é igual à soma das massas dos produtos (Lei da conservação das massas: “Na natureza, nada se cria, nada se perde, tudo se transforma”);
- A Lei de Proust indica que uma mesma substância sempre apresenta a mesma proporção dos elementos que a formaram (Lei das proporções definidas: “Uma determinada substância pura contêm sempre os mesmos elementos combinados na mesma proporção em massa, independente da sua origem”);
- A Lei de Dalton mostra que, nas mesmas condições de temperatura e pressão, os volumes dos gases participantes de uma reação química mantém entre si uma relação de números inteiros e pequenos (a Lei das proporções múltiplas: “Se dois elementos químicos formam mais de um composto químico entre eles, as razões das massas do segundo elemento para uma massa fixa do primeiro elemento também são pequenos números inteiros”).
Atentando às condições normais de temperatura e pressão (CNTP), que equivalem a 273 Kelvin e 1 atm, um mol de gás sempre ocupará 22,4L.
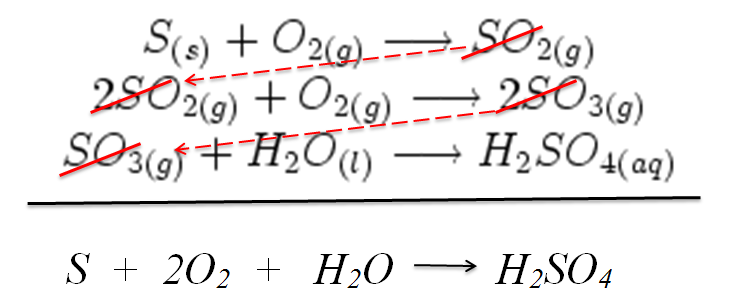
A constante de Avogadro, também importante no processo, é uma constante da natureza que corresponde numericamente ao número de átomos da massa atômica de uma substância, representando o mol, utilizado como padrão quantitativo.
O estudo da estequiometria é essencial para o bom entendimento das reações entre reagentes e produtos e ácidos e bases (reações de neutralização de ácidos). É muito comum em provas de vestibular e concursos públicos. Para maior compreensão do assunto, procure fazer exercícios para fixar o conteúdo
