Halogênios
Por Redação
5. Halogênios
Características
Na natureza não ocorrem livres:
F2 – gás amarelo claro
Cl2 – gás verde-amarelo
Br2 – líquido vermelho
I2 – sólido preto de brilho metálico, ele sublima a 184ºC, fazendo surgir vapor violeta.
At2(ástato) = sólido radioativo artificial.

A ordem decrescente dos receptores de elétrons é:
F2>Cl2>Br2>I2
O inverso é a reatividade dos íons haleto (X–) como doadores de elétrons:
I–>Br–>Cl–>F–
O íon (I–) prende o elétron mais externo, mais fracamente que o íon cloreto (Cl–) pelo fato que o íon (I–) ser maior.
Cl2 + 2I– → I2 + Cl–
Br2 + 2I → I2 + 2Br–
Cl2 + 2Br– → Br2 + 2Cl–
Só é possível retirar o elétron do F– por via eletrolítica, pelo fato de que não há energia o bastante para retirá-lo.
O cloro produz íons cloreto e hipoclorito,quando reage em água (0,1 mol/litro), porém ele é pouco solúvel.
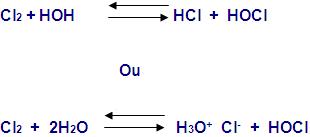
O ácido hipocloroso (oxidante) é formado na água de cloro, o que faz com que o cloro seja descorante.
Lembrando que o bromo reage de forma parecida.
A solubilidade do iodo aumenta na presença de iodeto de potássio, pois desta forma ocorre a formação de um íon complexo (triodeto).
I2 + I– → (I3)–
Ocorre reação no cloro com bases fortes, a frio ocorre produção de cloreto e hipoclorito.
![]()
A quente formam-se íons cloreto e clorato:
![]()
Preparação
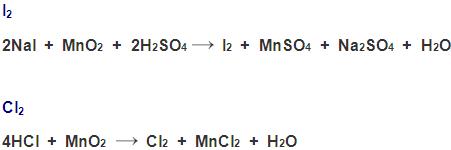
O gás cloro é mais denso que o ar.
