O que é Óxido Redução
Por Redação
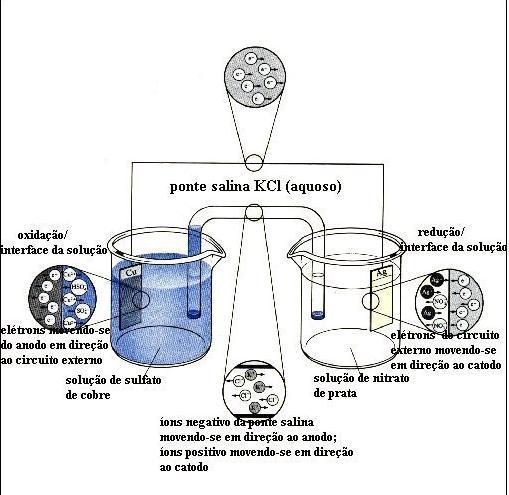
Óxido-redução
Significa transferência de elétrons e conseqüen-temente variação do n.° de oxidação (nox).
Conceitos
1. Oxidação: oxidar significa perder elétrons e conseqüentemente aumentar o nox.
2. Redução: reduzir significa ganhar elétrons e conseqüentemente diminuir o nox.
3. Agente oxidante: é a espécie química que contém o elemento que sofre redução. O oxidante provoca a oxidação de outra espécie química na reação.
4. Agente redutor: é a espécie química que contém o elemento que sofre oxidação. O redutor provoca a redução de outra espécie química na reação.
Observações:
1) Quem oxida ou quem reduz é sempre elemento químico.
2) O agente oxidante e o agente redutor sempre estão do lado dos reagentes da reação.
5. Número de oxidação: é a carga que o elemento tem ou adquire durante a reação.
Tipos de nox:
a) Nox real: é a carga que o elemento já possui. É característica de compostos iônicos.
b) Nox aparente: é a carga que o elemento adquire quando suas ligações forem rompidas durante a reação. É característica de compostos covalentes.
Obs.: Nox na ligação covalente dativa ou coordenada.
Situação “A”
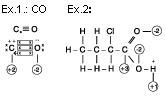
Situação “B”
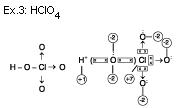
Regras para o cálculo de nox.
1.a O nox de uma substância simples ou de um elemento químico vale sempre zero.
