Análise gráfica do equílibrio
Por Redação
5. Analise gráfica do equilíbrio
Vamos fazer a representação gráfica do que aprendemos até o momento sobre equilíbrio químico.
Vamos colocar as velocidades da reação direta (v1) e inversa (v2) em ordenadas, e o tempo na abscissa.
No início, a velocidade da reação inversa (v2) está zerada, enquanto a velocidade da reação direta (v1) é máxima. Com o passar do tempo, a velocidade da reação inversa aumenta enquanto a velocidade da reação direta diminui. No instante te, a velocidade das duas reações são igualadas, e o equilíbrio é obtido.

Podemos obter outros gráficos, ao colocar na ordenada as concentrações de reagentes [R], ou produtos [P] ou ambos, e o tempo na abscissa.
No início, a concentração de reagente é máxima. No decorrer do tempo, ela vai reduzindo até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.
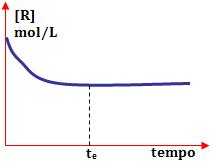
No início, a concentração do produto está zerada. No decorrer do tempo, ele aumenta até o instante te, onde torna-se constante e assim permanece. Neste momento, o equilíbrio é obtido.
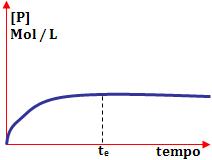
Quando falamos em situação de equilíbrio referente às concentrações de reagente e produtos, ela pode ser de três tipos:
1º) Ao obter o equilíbrio, a concentração de reagente é maior do que a de produto:
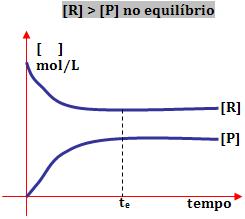
Este tipo de reação ocorre com maior extensão no sentido de formação dos reagentes.
2º) Ao obter o equilíbrio a concentração do produto é maior do que a de reagente:
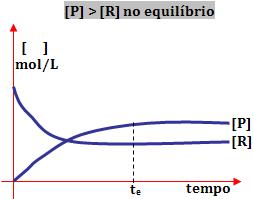
Este tipo de reação ocorre com maior extensão no sentido de formação dos produtos.
3º) Ao obter o equilíbrio, a concentração de reagente e a de produto é igual:
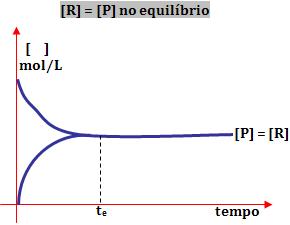
Tanto a reação direta como a reação inversa ocorre na mesma intensidade.
