Diagrama de estado
Por Redação
Diagrama de estado
O diagrama de estado de uma substância é composto por curvas de equilíbrio sólido + líquido, que é uma curva de solidificação-fusão, líquido + vapor que é uma curva de vaporização-liquefação e sólido + vapor que é uma curva de sublimação.
Como vimos anteriormente, é possível notar que há uma pequena diferença na curva da solidificação e fusão, portanto são obtidos dois diagramas de estado, uma para a maioria das substâncias e outro para as exceções.
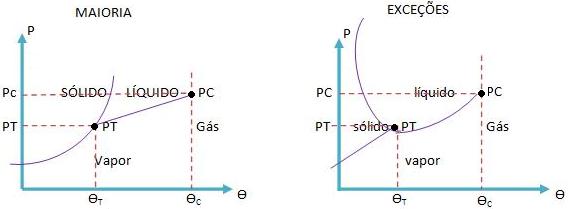
Ainda com base nos diagramas acima, podemos perceber que existe um ponto único do diagrama (p,ø), denominado ponto triplo (PT), em que pode haver uma existência simultânea dos estados sólido, líquido e gasoso, todos de uma mesma substância.
Existe também o PC (ponto crítico) e a øc (temperatura crítica). Essa temperatura é capaz de separar o vapor do gás. Veja que o estado físico do gás está relacionado com uma situação mais energizada das partículas do sistema gasoso.
Observe os diagramas abaixo:
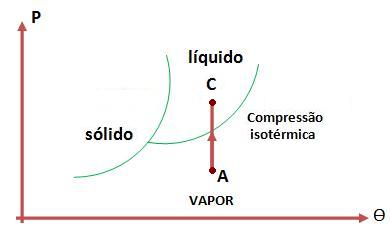
Podemos ver que tanto o gás como a compressão isotérmica, não são capazes de reunir as partículas que estão com o nível de energia maior que o vapor.
Vejamos agora mais um diagrama:
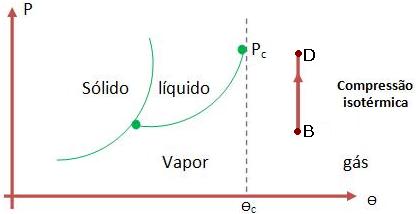
Logo, para que um gás seja transformado em um líquido, é preciso reduzir a temperatura do gás, até que ela fique mais baixa que a temperatura crítica, ou seja, até que ela se torne vapor. Após esse processo, basta comprimir o gás isotermicamente.
