Eletronegatividade e eletropositividade
Por Redação
9- Eletronegatividade e eletropositividade
A eletronegatividade é considerada uma propriedade que tem por objetivo medir a propensão que o átomo tem para poder receber os elétrons.
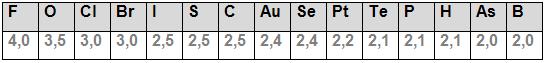
O flúor é o elemento que possui mais eletronegatividade, para ele foi concedido o valor de 4,0 de eletronegatividade. Isso foi definido a partir dos estudos de Linus Pauling que concedeu dissemelhanças de eletronegatividade entre 0 e 4,(ele calculou grande parte dos elementos) para o hidrogênio foi atribuído o valor de 2,1 e a condição de ser o elemento padrão.
Observe abaixo alguns dos resultados da eletronegatividade, obtidos por Linus Pauling:
É importante atentar a alguns fatores que interferem e influenciam na eletronegatividade:
– Elementos que possuem mais de 4 elétrons na camada de valência estão propensos a adquirir elétrons, conclui-se que há alta eletronegatividade e baixa eletropositividade.
Elementos que possuem menos de 4 elétrons na camada de valência estão propensos a perder elétrons, conclui-se então que há baixa eletronegatividade e alta eletropositividade.
– Os átomos de tamanhos menores estão propensos a exibir maior eletronegatividades, que os átomos com tamanhos maiores, então em um grupo o tamanho de um átomo aumenta de cima para baixo, na tabela periódica, o que resulta em uma eletronegatividade decrescente no mesmo sentido (de cima para baixo), portanto a eletronegatividade diminui do flúor para o iodo, isso ocorre no grupo VII.
Vejamos:
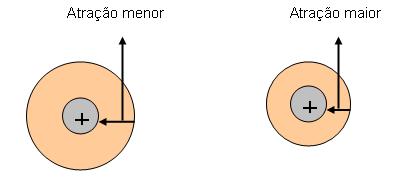
– Caso os átomos sejam quase do mesmo tamanho, a eletronegatividade será de acordo com a carga nuclear, portanto quanto maior a carga maior a eletronegatividade.
Observe o esquema abaixo:
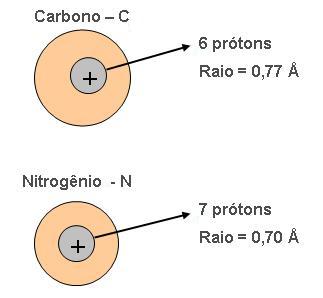
O nitrogênio é mais eletronegativo que o carbono. Então se conclui que nesse período a carga aumenta a eletronegatividade, da esquerda para a direita.
Vejamos agora a regra de Linus Pauling:
Para uma ligação ser iônica, segunda a regra de Linus Pauling deve haver uma dissemelhança de eletronegatividade entre os dois átomos maiores que 1,7. Já para uma ligação ser covalente, essa dissemelhança entre os dois átomos menores que 1,7. Portanto podemos concluir que quanto maior for essa dissemelhança, mais polar a ligação será.
Observe os exemplos:
NaCl
Cl – 3,0
Na – 0,9
Diferença de 2,1, portanto NaCl é iônico.
HCl
Cl – 3,0
H – 2,1
Diferença de 0,9, portanto HCl é covalente.
Na+I– Diferença de 1,6 porém é iônico.
A eletropositividade ou caráter metálico é a propriedade de medida para saber a tendência de um átomo para perder elétrons, ou seja, o oposto de eletronegatividade, quanto mais um elemento for eletropositivo, maior será o caráter metálico.
Portanto, o césio e o frâncio são elementos que possuem mais eletropositividade, e o flúor é o elemento que possui menos eletropositividade.
